Uusi koneoppimismalli ennustaa proteiinien sitoutumisen kultananoklustereihin – mahdollistaa uuden sukupolven biolääketieteellisten nanomateriaalien kehittämisen
Proteiinien kiinnittyminen nanomateriaalien pintoihin on olennaista monissa biologisissa sovelluksissa, kuten kuvantamisessa, biosensorissa ja kohdennetussa lääkeannostelussa. Kultananoklusterit ovat herättäneet erityisesti huomiota niiden biologisen yhteensopivuuden ja säädettävien optisten ominaisuuksien ansiosta. Nykyiset tutkimukset, joissa ennustetaan proteiinien vuorovaikutusta näiden ligandeilla suojattujen nanorakenteiden kanssa, keskittyvät kuitenkin usein yksittäisiin tapauksiin, jolloin tutkijoilla ei ole yhtenäistä mallia suunnittelun ohjaamiseksi.
- Tämä aukko on luonut selkeän tarpeen yleisille ja skaalautuville malleille, jotka pystyvät kuvaamaan proteiini-nanoklusteri-sitoutumisen taustalla olevia mekanismeja, täsmentää tutkijatohtori Brenda Ferrari Jyväskylän yliopistosta.
Koneoppimisen malli paljastaa biomolekyylien ja kultananoklusterien vuorovaikutuksen
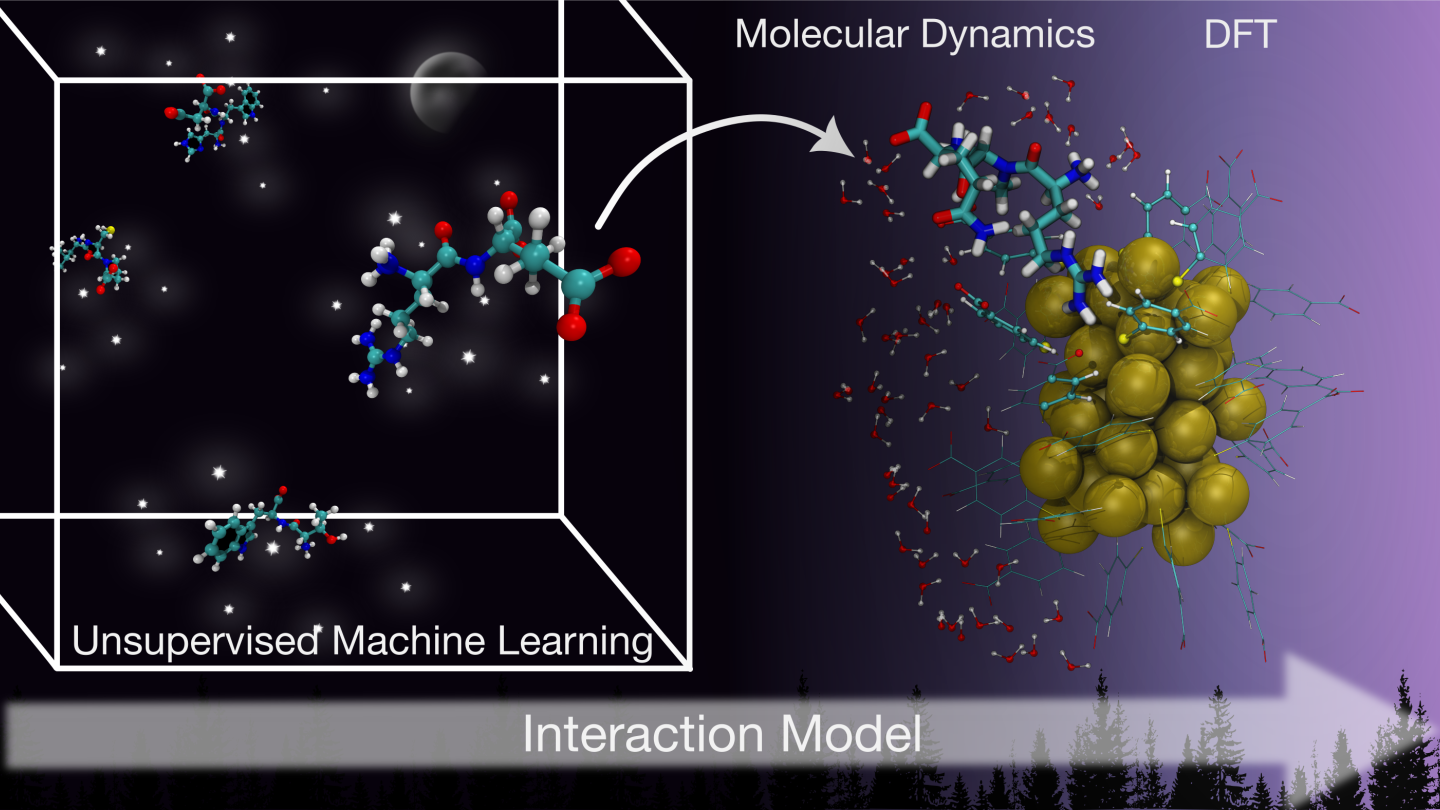
Ratkaistakseen tämän haasteen Nanotiedekeskuksen tutkijat ovat kehittäneet klusterointiin perustuvan koneoppimisen mallin, joka tunnistaa biomolekyylien kiinnittymisen kultananoklustereihin ohjaavat kemialliset periaatteet.
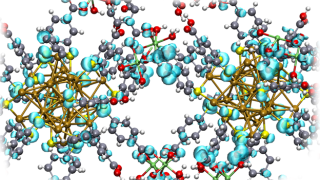
- Käyttämällä edistynyttä klusterointianalyysiä, joka on validoitu atomisimuloinneilla ja suoritettu CSC:n (Tieteen tietotekniikan keskus) LUMI-supertietokoneella, paljastimme peptidi-Au₃₈(p-MBA)₂₄-rajapinnan kemialliset säännöt. Malli määrittää, mitkä aminohapot sitoutuvat helpommin tai heikommin kultananoklustereihin. Lisäksi se tunnistaa näistä vuorovaikutuksista vastuussa olevat kemialliset ryhmät, kertoo Ferrari.
Yleispätevän mallin rakentaminen
Uusi malli on suunniteltu nimenomaan yleispäteväksi ja skaalautuvaksi. Se voi merkittävästi nopeuttaa suurten proteiinimäärien seulontaa ja tukea tehokkaampien nanomateriaalien kehittämistä biolääketieteellisiin sovelluksiin.
- Tavoitteenamme oli rakentaa malli, joka ei selitä vain yhtä tiettyä järjestelmää, vaan joka on yleistettävissä, sanoo Ferrari. Jatkossa tutkimme lisää mallin rajoitteita, mutta nyt meillä on jo malli, jota voidaan laajentaa selittämään laajasti proteiini-kulta-nanoklusterien vuorovaikutuksia ja tukemaan älykkäämpien nanomateriaalien kehittämistä biolääketieteelliseen käyttöön, hän jatkaa.
Tutkimus kaikkine koodeineen on julkaistu Aggregate-lehdessä.
Artikkelin tiedot:
- B. Ferrari, Z. Fallah, M. Khatun, and H. Häkkinen, “Development of an Interaction Model of the Protein–Nanocluster Interface by Machine Learning–Assisted Clustering of Amino Acids” Aggregate (2025): e70213.
-
DOI numero: https://doi.org/10.1002/agt2.70213